Antragsstellung gemäß Medizinprodukterecht-Durchführungsgesetz (MPDG) / EU-Verordnung Nr. 2017/745 (MDR)
Der Entscheidungsbaum gibt eine erste Übersicht zur rechtlichen Einordnung Ihres Forschungsvorhabens.
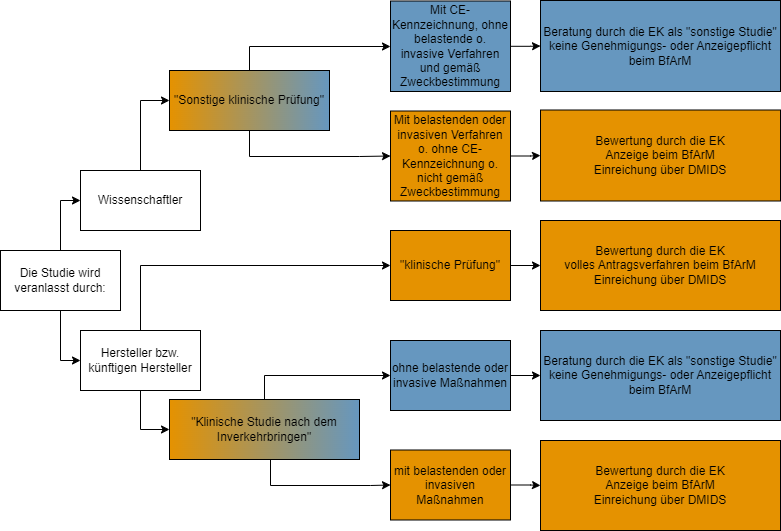
Einen ausführlicheren Entscheidungsbaum zur rechtlichen Einordnung gemäß MDR/MPDG finden Sie auf den Seiten des BfArM.
Eine Klinische Prüfung bezeichnet eine systematische Untersuchung, bei der ein oder mehrere menschliche Prüfungsteilnehmer einbezogen sind und die zwecks Bewertung der Sicherheit oder Leistung eines Produkts durchgeführt wird.
Eine sonstige klinische Prüfung eines Produktes ist eine klinische Prüfung, die
- nicht Teil eines systematischen und geplanten Prozesses zur Produktentwicklung oder der Produktbeobachtung eines gegenwärtigen oder künftigen Herstellers ist,
- nicht mit dem Ziel durchgeführt wird, die Konformität eines Produktes mit den Anforderungen der Verordnung (EU) 2017/745 nachzuweisen,
- der Beantwortung wissenschaftlicher oder anderer Fragestellungen dient und
- außerhalb eines klinischen Entwicklungsplans nach Anhang XIV Teil A Ziffer 1 Buchstabe a der Verordnung (EU) 2017/745 erfolgt
Eine klinische Prüfung nach dem Inverkehrbringen dient der weitergehenden Bewertung eines Produkts im Rahmen seiner Zweckbestimmung, das bereits die CE-Kennzeichnung trägt.
Eine Übersicht zu zusätzlichen invasiven oder anderen belastenden Maßnahmen finden Sie hier.
Die Antragstellung für klinische Prüfung nach MPDG sowie sonstige klinische Prüfungen erfolgt elektronisch über das Deutsche Medizinprodukte-Informations- und Datenbanksystem (DMIDS).


